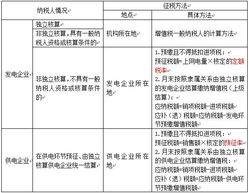
隨著全球生物醫(yī)藥產(chǎn)業(yè)的快速發(fā)展,生物制品的跨境轉(zhuǎn)移日益頻繁。對于希望將境外生物制品引入中國市場的內(nèi)資公司而言,選擇合適的注冊路徑至關(guān)重要。根據(jù)中國國家藥品監(jiān)督管理局(NMPA)的相關(guān)規(guī)定,生物制品從境外轉(zhuǎn)移到境內(nèi)主要有三大注冊路徑:進(jìn)口注冊、境內(nèi)生產(chǎn)注冊和技術(shù)轉(zhuǎn)移注冊。以下將詳細(xì)闡述這三種路徑的特點(diǎn)、適用場景及流程。
進(jìn)口注冊路徑適用于境外已上市的生物制品直接進(jìn)入中國市場。該路徑要求境外生產(chǎn)企業(yè)與中國內(nèi)資公司合作,由內(nèi)資公司作為注冊申請人,提交完整的注冊資料,包括境外臨床數(shù)據(jù)、質(zhì)量研究、生產(chǎn)工藝等。NMPA將進(jìn)行技術(shù)審評和現(xiàn)場核查,確保產(chǎn)品符合中國的安全、有效和質(zhì)量標(biāo)準(zhǔn)。優(yōu)勢在于可以利用境外已有的研發(fā)成果,縮短上市時間,但需注意數(shù)據(jù)跨境合規(guī)性和本地化臨床補(bǔ)充試驗(yàn)的可能要求。
境內(nèi)生產(chǎn)注冊路徑涉及將境外生物制品的生產(chǎn)技術(shù)轉(zhuǎn)移到中國境內(nèi),由內(nèi)資公司自行生產(chǎn)。此路徑適用于希望實(shí)現(xiàn)本土化生產(chǎn)的公司,需提交技術(shù)轉(zhuǎn)移方案、境內(nèi)生產(chǎn)設(shè)施驗(yàn)證、質(zhì)量一致性研究等資料。NMPA會重點(diǎn)審核生產(chǎn)過程的合規(guī)性和產(chǎn)品與原產(chǎn)國的一致性。該路徑有助于降低成本、提升供應(yīng)鏈穩(wěn)定性,但需要投入更多資源在廠房建設(shè)、人員培訓(xùn)和質(zhì)量體系建設(shè)上。
第三,技術(shù)轉(zhuǎn)移注冊路徑結(jié)合了進(jìn)口和境內(nèi)生產(chǎn)的特點(diǎn),通常適用于境外企業(yè)與內(nèi)資公司合作,通過技術(shù)許可或合資方式實(shí)現(xiàn)產(chǎn)品轉(zhuǎn)移。注冊時需提供技術(shù)轉(zhuǎn)移協(xié)議、知識產(chǎn)權(quán)證明、以及境內(nèi)外的對比研究數(shù)據(jù)。該路徑靈活性高,可以加速產(chǎn)品本土化進(jìn)程,同時規(guī)避部分進(jìn)口壁壘,但需妥善處理技術(shù)保密和權(quán)益分配問題。
內(nèi)資公司在選擇生物制品境外轉(zhuǎn)移的注冊路徑時,應(yīng)綜合考慮產(chǎn)品特性、市場策略和資源能力。進(jìn)口注冊適合快速上市,境內(nèi)生產(chǎn)注冊有利于長期本土化,技術(shù)轉(zhuǎn)移注冊則提供了合作共贏的中間方案。建議企業(yè)在決策前咨詢專業(yè)法規(guī)機(jī)構(gòu),確保合規(guī)高效地完成注冊流程,推動生物制品在中國的成功落地。